鄭州源創基因科技有限公司成立于2016年,由哥倫比亞大學博士后趙輝,歸國創辦的國家高新技術企業。擁有97項知識產權及實用技術,業務遍布上海、重慶、深圳、北京等城市,總部在鄭州航空港區。
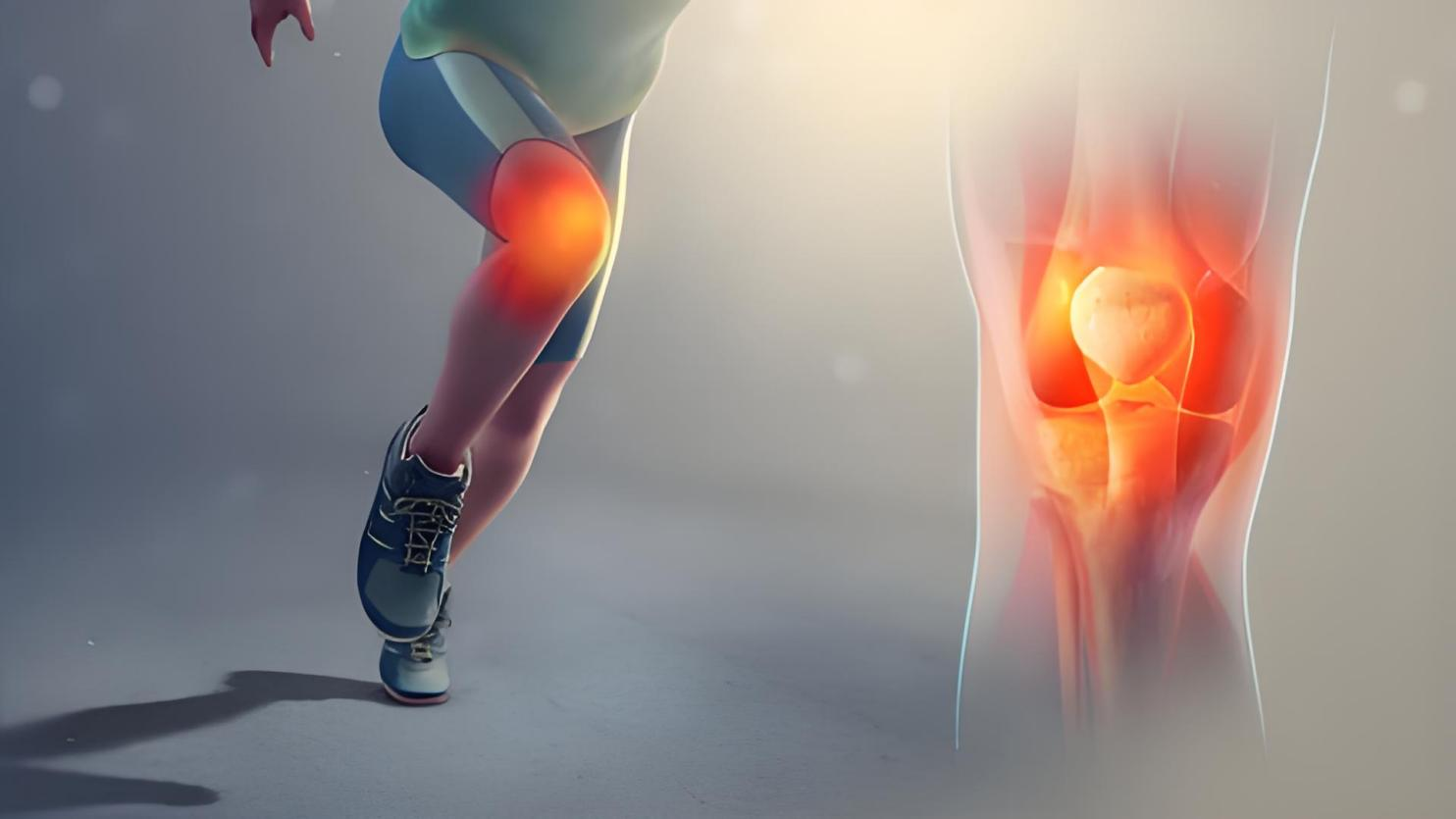
OA先前主要是關節軟骨破壞,但越來越多的證據表明OA是一種伴有全關節損傷和功能障礙的疾病。在骨性關節炎進展過程中,關節的病理改變包括軟骨損傷、軟骨下骨重塑、滑膜炎癥活化、韌帶和半月板退變、關節囊、粘液囊、關節周圍肌肉、神經和局部脂肪墊的改變。
外泌體被認為是參與許多生理和病理過程的細胞間通訊的重要介質。最近,外泌體在 OA 中的作用和治療潛力在這一領域得到了越來越多的關注。
外泌體,細胞間通訊介質
細胞外囊泡 (EV) 是膜結合載體,可分為三種類型,包括外泌體、微囊泡 (MV) 和凋亡小體。作為一種重要的 EV,外泌體在過去十年中受到了最多的關注。外泌體可以由各種細胞分泌,并通過其內容物(包括脂質、核酸和蛋白質)介導細胞間通訊。
外泌體的直徑通常在30-150 nm之間,密度在1.13-1.19 g·mL-1.19之間。發現脫落的膜囊泡可能具有生理功能,并建議將這些囊泡作為外泌體。1983 年,Harding 等人,觀察到膜結合囊泡可以通過多囊泡內體 (MVE) 胞吐作用釋放。1987 年,Johnstone 等人,觀察到網織紅細胞成熟過程中的外泌體釋放與質膜活性有關。2007 年,Valadi 等人。發現 mRNA 和 microRNA 可以通過外泌體發送到其他細胞,表明外泌體可能通過遞送核酸來介導細胞間通訊。此后,越來越多的研究表明外泌體通過介導細胞間通訊發揮重要的生理和病理作用。
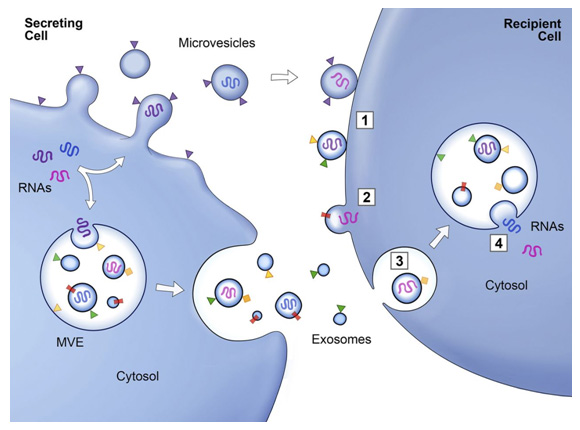
外泌體的產生過程
在人類關節腔中可檢測到外泌體,并觀察到隨著 OA 的進展而發生變化。幾種關節細胞,包括軟骨細胞、滑膜成纖維細胞、成骨細胞和肌腱細胞,可以產生和分泌影響靶細胞生物學效應的外泌體。此外,來自干細胞的外泌體可以通過促進軟骨修復、抑制滑膜炎和介導軟骨下骨重塑來保護 OA 關節免受損傷。
干細胞衍生外泌體對OA的治療效果
最近的研究報告稱,外泌體作為一種新的細胞間通信手段,通過輸送多種生物活性分子來創建一個調節軟骨行為的特定微環境。具體而言,外泌體貨物,如非編碼RNA(ncRNA)和蛋白質,通過調節關節細胞的增殖、凋亡、自噬和炎癥反應,在OA進展中發揮關鍵作用,使其成為OA監測和治療的理想候選物。干細胞如骨髓間充質干細胞(BMSCs)和脂肪間充質干細胞(AMSCs)表現出有效的軟骨再生能力,并已針對OA治療的臨床試驗和臨床測試。表現出可靠的安全性和可行性,而這種方法可以改善膝關節社會臨床評級系統(KSS)和OA結果得分,并部分緩解膝關節疼痛。
來自骨髓間充質干細胞的外泌體
源自 BMSC 的外泌體可以影響細胞命運,包括細胞凋亡、增殖、侵襲和遷移。此外,源自 BMSC 的外泌體可以調節多種生理和病理過程,包括免疫反應、成骨、纖維化和血管生成。幾項研究報告稱,BMSC 衍生的外泌體顯著促進受損組織的再生和修復,包括軟骨和軟骨下骨。來自 TGFβ3 預處理的 BMSC 的外泌體以及 MV/微粒 (MP) 顯著增加了骨關節炎軟骨細胞中合成代謝標記的表達并降低了分解代謝標記基因的水平。此外,這些 BMSC 衍生的外泌體可以防止骨關節炎軟骨細胞發生細胞凋亡。
來自滑膜間充質干細胞的外泌體
滑膜間充質干細胞 (SMSC) 在體外顯示出更好的軟骨分化能力。研究發現來自 OA 或 RA 患者的 SMSCs 可以在體外和體內使用同種異體組織工程構建體有效增強軟骨修復。在實驗動物模型中,關節內注射 SMSCs 可以顯著促進軟骨修復并用于治療關節相關疾病,包括 OA。此外,SMSC-140-Exo 治療顯著減輕了大鼠 OA 模型中的關節磨損,降低了 OARSI 評分并延遲了 OA 進展。
來自脂肪組織間充質干細胞的外泌體
脂肪組織間充質干細胞 (AMSCs) 被證明具有強大的軟骨再生和炎癥調節能力,被認為是 OA 治療的極好細胞來源。然而,AMSC 誘導軟骨再生的機制仍不清楚。越來越多的證據表明,AMSCs 可能主要通過旁分泌營養因子來調節局部微環境,從而防止軟骨侵蝕并改善關節功能,使其更利于修復和再生。據報道,EVs,包括 MVs 和外泌體,主要介導 AMSCs 對骨關節炎成骨細胞的旁分泌作用。此外,AMSC 衍生的 MV 和外泌體可以抑制促炎介質的產生,如 TNF-α、IL-6、PGE2 和 NO,以及 MMP 活性和 MMP-13 水平,同時增加抗炎細胞因子 IL 的水平-10 和 OA 軟骨細胞中的軟骨細胞特異性分子膠原蛋白 II,209 這表明 AMSC 衍生的 MV 和外泌體具有潛在的抗炎和軟骨保護作用。
最新成果:外泌體+支架,促進軟骨損傷修復
中國醫科大學附屬第一醫院李旭研究團隊發現,臍源間充質干細胞外泌體(MSC-Exos)結合脫細胞軟骨細胞外基質(ACECM)支架,可促進軟骨缺損的再生修復。該研究發表于Bioactive Materials 雜志上:
本研究首次將臍源間充質干細胞外泌體與ACECM支架相結合,修復骨軟骨缺損。本研究證實,間充質干細胞外泌體可以提高兔骨軟骨缺損模型中ACECM支架的修復效果。這種作用可能是由于EXO促進內源性MSC和軟骨細胞增殖、抑制關節腔內炎癥,以及EXO和外泌體miRNA促進軟骨ECM合成,從而實現的。
基于MSC-Exos和ACECM支架的“無細胞”組織工程策略是實現骨軟骨再生的有效方法。鑒于來源于人軟骨基質的ACECM支架已成功應用于臨床,這種新型的“無細胞”組織工程軟骨具有廣闊的臨床轉化前景。
展望
作為一種重要的細胞間通訊介質,外泌體極大地促進了 OA 的發生和進展,并已顯示出用于 OA 治療的強大潛力。探索外泌體在 OA 病理變化中的詳細機制將有助于我們篩選和識別潛在的治療靶點。此外,我們需要優化 MSC-Exos 以提高其對 OA 的治療效果。關于外泌體在 OA 中的作用、潛在機制和診斷/治療應用的研究才剛剛開始,該領域仍有許多問題需要解決。隨著技術的進步,我們堅信未來細胞外泌體將會廣泛地應用于 OA 患者,發揮更大的骨關節炎治調理作用。
圖片:來源于網絡